Биологический факультет
Кафедра биофизики
119991, Москва, ГСП-2, Ленинские горы. Телефон (495) 939-1116, факс 939-1115.
| ! | Это архивная версия сайта кафедры биофизики от 2020 года. Актуальный сайт доступен по адресу https://www.biophys.msu.ru/. |
Прямые многочастичные модели взаимодействия белков
Прямые многочастичные модели взаимодействия белков призваны ответить на вопрос, как характеристики отдельных молекул (структура, форма, распределение локальных зарядов) и молекулярных комплексов, взаимодействуя в ансамбле in vitro или в сложном интерьере клетки, проявляются в виде «макропоказателей», которые мы регистрируем биохимическими или спектральными методами.
С использованием баз данных по белкам строятся модели, учитывающие пространственную структуру белков и их электрические заряды (эквипотенциальные поверхности). На компьютере имитируется броуновское движение нескольких сотен молекул белков в растворе, изучается процесс докинга образования комплекса двух белков, предшествующее акту реакции (например, при окислительно-восстановительной реакции переносу электрона с реакционного центра одной молекулы на реакционный центр другой). В отличие от молекулярной динамики, где моделируется отдельная молекула или молекулярный комплекс, в прямых многочастичных моделях мы рассматриваем ансамбли взаимодействующих молекул. На вероятность их взаимодействия влияет не только структура и форма молекул, их локальные заряды, но и свойства среды (например, вязкость), геометрия объема, в котором происходит взаимодействие.
С помощью прямого многочастичного моделирования изучаются детали электростатического взаимодействия пластоцианина и цитохрома f в растворе. Белки представлены в виде твердых тел с пространственно фиксированными зарядами. Поступательное и вращательное движение белков является результатом взаимодействия броуновских и электростатических сил. Для пространственного описания электростатического потенциала, генерируемого вокруг белков, использован формализм Пуассона-Больцмана.
На основании представлений о механизмах единичного акта докинга и законах движения молекул модель позволяет понять, от каких биофизических величин зависит величина константы скорости реакции, которой мы привыкли оперировать в экспериментальных исследованиях и кинетических моделях.
Знания о деталях взаимодействия отдельных белков и их влиянии на общую скорость реакции важны для биомедицинских исследований, биоинженерии, биоэнергетики.
Иллюстрации:
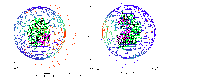 Расчитанные эквипотенциальные поверхности белков барназа (внеклеточная РНКаза Bacillus amyloliquefaciens) и барстар (внутриклеточный ингибитор барназы) обозначены точками. На глобусной сетке красным отмечены области наиболее вероятного взаимодействия этих белков в процессе предокинга – сближения молекул для образования мультимолекулярного комплекса.
Расчитанные эквипотенциальные поверхности белков барназа (внеклеточная РНКаза Bacillus amyloliquefaciens) и барстар (внутриклеточный ингибитор барназы) обозначены точками. На глобусной сетке красным отмечены области наиболее вероятного взаимодействия этих белков в процессе предокинга – сближения молекул для образования мультимолекулярного комплекса.
 Аппроксимация поверхности белков пластоцианина и цитохрома f набором сфер для моделирования столкновений. Зеленым цветом показаны молекулы, синим – аппроксимация сферами.
Аппроксимация поверхности белков пластоцианина и цитохрома f набором сфер для моделирования столкновений. Зеленым цветом показаны молекулы, синим – аппроксимация сферами.
 Эквипотенциальные поверхности белков пластоцианина и цитохрома f, рассчитанные по уравнению Пуассона-Больцмана. Ионная сила - 100 mM, pH=7, εр-ра=80; εбелка =2; красный цвет -6.5 мВ, синий + 6.5 мВ; зеленым цветом обозначены атомы молекул.
Эквипотенциальные поверхности белков пластоцианина и цитохрома f, рассчитанные по уравнению Пуассона-Больцмана. Ионная сила - 100 mM, pH=7, εр-ра=80; εбелка =2; красный цвет -6.5 мВ, синий + 6.5 мВ; зеленым цветом обозначены атомы молекул.
По теме работают: к. ф.-м. н. Илья Борисович Коваленко, аспирант Анна Михайловна Абатурова, к.ф.-м.н. Дмитрий Михайлович Устинин. Работа ведется в сотрудничестве с кафедрой компьютерных методов в физике Физического ф-та МГУ (проф. Алексей Иванович Чуличков, доцент Евгений Александрович Грачев, аспирант Павел Андреевич Громов).
![[Кафедра биофизики]](/images/logo.jpg)